4.4.1. Гипотеза де Бройля
Важным этапом в создании квантовой механики явилось обнаружение волновых свойств микрочастиц. Идея о волновых свойствах была первоначально высказана как гипотеза французским физиком Луи де Бройлем.
В физике в течение многих лет господствовала теория, согласно которой свет есть электромагнитная волна. Однако после работ Планка (тепловое излучение), Эйнштейна (фотоэффект) и других стало очевидным, что свет обладает корпускулярными свойствами.
Чтобы объяснить некоторые физические явления, необходимо рассматривать свет как поток частиц-фотонов. Корпускулярные свойства света не отвергают, а дополняют его волновые свойства.
Итак, фотон-элементарная частица света, обладающая волновыми свойствами.
Формула для импульса фотона
| . | (4.4.3) |
По де Бройлю, движение частицы, например, электрона, подобно волновому процессу с длиной волны λ , определяемой формулой (4.4.3). Эти волны называют волнами де Бройля . Следовательно, частицы (электроны, нейтроны, протоны, ионы, атомы, молекулы) могут проявлять дифракционные свойства.
К.Дэвиссон и Л.Джермер впервые наблюдали дифракцию электронов на монокристалле никеля.
Может возникнуть вопрос: что происходит с отдельными частицами, как образуются максимумы и минимумы при дифракции отдельных частиц?
Опыты по дифракции пучков электронов очень малой интенсивности, то есть как бы отдельных частиц, показали, что при этом электрон не "размазывается" по разным направлениям, а ведет себя как целая частица. Однако вероятность отклонения электрона по отдельным направлениям в результате взаимодействия с объектом дифракции различная. Наиболее вероятно попадание электронов в те места, которые по расчету соответствуют максимумам дифракции, менее вероятно их попадание в места минимумов. Таким образом, волновые свойства присущи не только коллективу электронов, но и каждому электрону в отдельности.
4.4.2. Волновая функция и ее физический смысл
Так как с микрочастицей сопоставляют волновой процесс, который соответствует ее движению, то состояние частиц в квантовой механике описывается волновой функцией, зависящей от координат и времени: .
Если силовое поле, действующее на частицу, является стационарным, то есть не зависящим от времени, то ψ-функцию можно представить в виде произведения двух сомножителей, один из которых зависит от времени, а другой от координат:
Отсюда следует физический смысл волновой функции:
4.4.3. Соотношение неопределенностей
Одним из важных положений квантовой механики являются соотношения неопределенностей, предложенные В.Гейзенбергом.
Пусть одновременно измеряют положение и импульс частицы, при этом неточности в определениях абсциссы и проекции импульса на ось абсцисс равны соответственно Δx и Δр x .
В классической физике нет каких-либо ограничений, запрещающих с любой степенью точности одновременно измерить как одну, так и другую величину, то есть Δx→0 и Δр x→ 0.
В квантовой механике положение принципиально иное: Δx и Δр x , соответствующие одновременному определению x и р x , связаны зависимостью
Формулы (4.4.8), (4.4.9) называют соотношениями неопределенностей .
Поясним их одним модельным экспериментом.
При изучении явления дифракции было обращено внимание на то, что уменьшение ширины щели при дифракции приводит к увеличению ширины центрального максимума. Аналогичное явление будет и при дифракции электронов на щели в модельном опыте. Уменьшение ширины щели означает уменьшение Δ x (рис. 4.4.1), это приводит к большему "размазыванию" пучка электронов, то есть к большей неопределенности импульса и скорости частиц.

Рис. 4.4.1.Пояснение к соотношению неопределенности.
Соотношение неопределенностей можно представить в виде
| , | (4.4.10) |
где ΔE - неопределенность энергии некоторого состояния системы; Δt -промежуток времени, в точение которого оно существует. Соотношение (4.4.10) означает, что чем меньше время существования какого-либо состояния системы, тем более неопределенно его значение энергии. Энергетические уровни Е 1 , Е 2 и т.д. имеют некоторую ширину (рис.4.4.2)), зависящую от времени пребывания системы в состоянии, соответствующем этому уровню.

Рис. 4.4.2.Энергетические уровни Е 1 , Е 2 и т.д. имеют некоторую ширину.
"Размытость" уровней приводит к неопределенности энергии ΔE излучаемого фотона и его частоты Δν при переходе системы с одного энергетического уровня на другой:
![]() ,
,
где m- масса частицы; ; Е и Е n -ее полная и потенциальная энергии (потенциальная энергия определяется силовым полем, в котором находится частица, и для стационарного случая не зависит от времени)
Если частица перемещается только вдоль некоторой линии, например вдоль оси ОХ (одномерный случай), то уравнение Шредингера существенно упрощается и принимает вид
| (4.4.13) |
Одним из наиболее простых примеров на использование уравнения Шредингера является решение задачи о движении частицы в одномерной потенциальной яме.
4.4.5. Применение уравнения Шредингера к атому водорода. Квантовые числа
Описание состояний атомов и молекул с помощью уравнения Шредингера является достаточно сложной задачей. Наиболее просто она решается для одного электрона, находящегося в поле ядра. Такие системы соответствуют атому водорода и водородоподобным ионам (однократно ионизированный атом гелия, двукратно ионизированный атом лития и т.п.). Однако и в этом случае решение задачи является сложным, поэтому ограничимся лишь качественным изложением вопроса.
Прежде всего в уравнение Шредингера (4.4.12) следует подставить потенциальную энергию, которая для двух взаимодействующих точечных зарядов - e (электрон) и Ze (ядро), - находящихся на расстоянии r в вакууме, выражается следующим образом:
Это выражение является решением уравнения Шредингера и полностью совпадает с соответствующей формулой теории Бора (4.2.30)
На рис.4.4.3 показаны уровни возможных значений полной энергии атома водорода (Е 1 , Е 2 , Е 3 и т.д.) и график зависимости потенциальной энергии Е n от расстояния r между электроном и ядром. С возрастанием главного квантового числа n увеличивается r (см.4.2.26), а полная (4.4.15) и потенциальная энергии стремятся к нулю. Кинетическая энергия также стремится к нулю. Заштрихованная область (Е>0) соответствует состоянию свободного электрона.

Рис. 4.4.3. Показаны уровни возможных значений полной энергии атома водорода
и график зависимости потенциальной энергии от расстояния r между электроном и ядром.
Второе квантовое число - орбитальное l , которое при данном n может принимать значения 0, 1, 2, …., n-1. Это число характеризует орбитальный момент импульса L i электрона относительно ядра:
Четвертое квантовое число - спиновое m s . Оно может принимать только два значения (±1/2) и характеризует возможные значения проекции спина электрона:
| .(4.4.18) |
Состояние электрона в атоме с заданными n и l обозначают следующим образом: 1s, 2s, 2p, 3s и т.д. Здесь цифра указывает значение главного квантового числа, а буква - орбитальное квантовое число: символам s, p, d, f, соответствуют значения l=0, 1, 2. 3 и т.д.
Квантовой механикой называют современную теорию, устанавливающую способ описания и законы движения микрочастиц (элементарных частиц, атомов, молекул, ядер) и их систем. Необычность квантово-механических представлений по сравнению с классической физикой открыла период ломки основных физических моделей, которые казались очевидными и нерушимыми. Главным образом это коснулось понятия частицы и принципов ее движения.
В этой главе дается понятие не только о квантовой механике, но и о тех идеях и опытах, которые привели к этой теории. Как метод, основанный на волновых свойствах электронов, рассматривается электронная микроскопия.
28.1. ГИПОТЕЗА ДЕ БРОЙЛЯ. ОПЫТЫ ПО ДИФРАКЦИИ ЭЛЕКТРОНОВ И ДРУГИХ ЧАСТИЦ
Важным этапом в создании квантовой механики явилось обнаружение волновых свойств микрочастиц. Идея о волновых свойствах была первоначально высказана как гипотеза французским физиком Луи де Бройлем (1924) 1 .
В физике в течение многих лет господствовала теория, согласно которой свет есть электромагнитная волна. Однако после работ Планка (тепловое излучение), Эйнштейна (фотоэффект) и других стало очевидным, что свет обладает корпускулярными свойствами.
1 Гипотеза де Бройля была сформулирована до опытов, подтверждающих волновые свойства частиц. Де Бройль об этом позднее, в 1936 г. писал так: «... не можем ли мы предположить, что и электрон так же двойственен, как и свет? На первый взгляд такая идея казалась очень дерзкой. Ведь мы всегда представляли себе электрон в виде электрически заряженной материальной точки, которая подчиняется законам классической динамики. Электрон никогда явно не проявлял волновых свойств, таких, скажем, какие проявляет свет в явлениях интерференции и дифракции. Попытка приписать волновые свойства электрону, когда этому нет никаких экспериментальных доказательств, могла выглядеть как ненаучная фантазия».
В гл. 24 было отмечено, что дифракция рентгеновских лучей наблюдается на кристаллических телах; следовательно, для дифракции электронов необходимо также использовать кристаллические вещества.
К. Дэвиссон и Л. Джермер впервые наблюдали дифракцию электронов на монокристалле никеля, Дж.П. Томсон и независимо от него П.С. Тартаков-ский - на металлической фольге (по-ликристаллиаеское тело).

На рис. 28.1 изображена электроно-грамма - дифракционная картина, полученная от взаимодействия электронов с поликристаллической фольгой.
Сравнивая этот рисунок с рис. 24.21, можно заметить сходство дифракции электронов и рентгеновских лучей.
Способностью дифрагировать обладают и другие частицы, как заряженные (протоны, ионы и др.), так и нейтральные (нейтроны, атомы, молекулы).
Аналогично рентгеноструктурному анализу можно применять дифракцию частиц для определения упорядоченного или разупорядочен-ного расположения атомов и молекул вещества и для оценки параметров кристаллических решеток.
В настоящее время широкое распространение имеют методы электронографии (дифракция электронов) и нейтронографии (дифракция нейтронов).
Могут возникнуть вопросы: что происходит с отдельными частицами, как образуются максимумы и минимумы при дифракции отдельных частиц?
Опыты по дифракции пучков электронов очень малой интенсивности, т.е. как бы отдельных частиц, показали, что при этом электрон не «размазывается» по разным направлениям, а ведет себя как целая частица. Однако вероятность отклонения электрона по отдельным направлениям в результате взаимодействия с объектом дифракции различная. Наиболее вероятно попадание электронов в те места, которые по расчету соответствуют максимумам дифракции, менее вероятно их попадание в места минимумов. Таким образом, волновые свойства присущи не только коллективу электронов, но и каждому электрону в отдельности.
28.2. ЭЛЕКТРОННЫЙ МИКРОСКОП. ПОНЯТИЕ ОБ ЭЛЕКТРОННОЙ ОПТИКЕ
Волновые свойства частиц можно использовать не только для дифракционного структурного анализа, но и для получения увеличенных изображений предмета.
Из (26.19) следует, что предел разрешения оптического микроскопа в основном определяется предельным значением длины волны света, воспринимаемого глазом человека. Подставив в эту формулу значение длины волны де Бройля (28.3), найдем предел разрешения электронного микроскопа, в котором изображение предмета формируется электронными пучками:
Как нетрудно убедиться, предел разрешения z электронного микроскопа зависит от ускоряющего напряжения, и можно добиться, чтобы он был значительно меньше, а разрешающая способность значительно больше, чем у оптического микроскопа.
Электронный микроскоп и его отдельные элементы по своему назначению подобны оптическому, поэтому воспользуемся аналогией для объяснения его устройства и принципа действия. Схемы обоих микроскопов изображены на рис. 28.2 (а - оптический; б - электронный).
В оптическом микроскопе носителем информации о предмете АВ является фотон, свет. Источником света обычно служит лампа накаливания /. После взаимодействия с предметом (поглощение, рассеяние, дифракция) поток фотонов преобразуется и содержит информацию о предмете. Поток фотонов формируется с помощью оптических устройств, в основном линз: конденсора 3, объектива 4, окуляра 5. Изображение А 1 В 1 регистрируется глазом 7 (или фотопластинкой, фотолю-минесцирующим экраном и т.д.).
В электронном микроскопе носителем информации о предмете является электрон, а источником электронов - подогреваемый катод 1. Ускорение электронов и образование пучка осуществляют фокусирующим электродом и анодом - системой, называемой электронной пушкой 2. После взаимодействия с предметом (в основном рассеяние) поток электронов преобразуется и содержит информацию о предмете. Формирование потока электронов происходит под воздействием электрического поля (система электродов и конденсаторов) и магнитного (систе-

ма катушек с током). Эти системы называют электронными линзами по аналогии с оптическими линзами, которые формируют световой поток (3 - конденсорная; 4 - электронная, служащая объективом, 5 - проекционная). Изображение регистрируется на чувствительной к электронам фотопластинке или катодолюминесцирующем экране 6.
Чтобы оценить предел разрешения электронного микроскопа, подставим в формулу (28.4) ускоряющее напряжение 100 кВ и угловую апертуру порядка 10 -2 рад (приблизительно такие углы используют в электронной микроскопии). Тогда получим z ~ 0,1 нм, что в сотни раз лучше, чем у оптических микроскопов. Применение ускоряющего напряжения, большего 100 кВ, хотя и повышает разрешающую способность, но связано с некоторыми сложностями, в частности происходит
разрушение исследуемого объекта электронами, имеющими большую скорость. Практически даже с помощью самого хорошего электронного микроскопа можно достичь предела разрешения порядка 10 -10 м; это в сотни раз лучше, чем у оптических микроскопов.
К достоинствам электронного микроскопа следует отнести большую разрешающую способность, позволяющую рассматривать крупные молекулы, возможность изменять при необходимости ускоряющее напряжение и, следовательно, предел разрешения и сравнительно удобное управление потоком электронов с помощью магнитных и электрических полей.
Укажем некоторые особенности эксплуатации электронного микроскопа. В тех частях его, где пролетают электроны, должен быть вакуум, так как в противном случае столкновение электронов с молекулами воздуха (газа) приведет к искажению изображения. Это требование к электронной микроскопии усложняет процедуру исследования, делает аппаратуру более громоздкой и дорогой. Вакуум искажает нативные свойства биологических объектов, а в ряде случаев разрушает или деформирует их.
Для рассматривания в электронном микроскопе пригодны лишь очень тонкие срезы, так как электроны сильно поглощаются и рассеиваются веществом. Поэтому в некоторых случаях целесообразно сделать оттиск исследуемой поверхности объекта на тонком слое пластмассы. Эту процедуру называют репликацией, а пластмассовую копию поверхности - репликой.

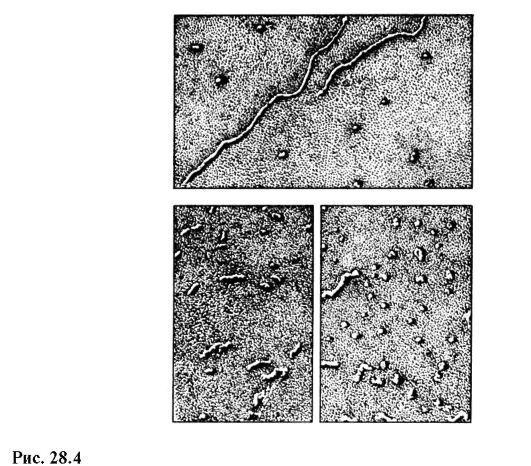
Современный отечественный электронный микроскоп ЭВМ-100 ЛМ (рис. 28.3) дает максимальное 600 000-кратное увеличение и гарантированный предел разрешения 3 ? 10 -10 м. На рис. 28.4 приведены снимки молекул РНК в разных состояниях, полученные на электронном микроскопе с увеличением в 100 000 раз.
Наличие волновых и корпускулярных свойств как у фотонов, так и у электронов и других частиц позволяет ряд положений и законов оптики распространить и на описание движения заряженных частиц в электрических и магнитных полях.
Эта аналогия позволила выделить как самостоятельный раздел электронную оптику - область физики, в которой изучается структура пучков заряженных частиц, взаимодействующих с электрическими и магнитными полями. Как и обычную оптику, электронную можно подразделить на геометрическую (лучевую) и волновую (физическую).
В рамках геометрической электронной оптики, в частности, описывается движение заряженных частиц в электрическом и магнитном полях. Схематическое изображение построения изображения в электронном микроскопе (см. рис. 28.2, б) основывается на геометрической электронной оптике.
Подход волновой электронной оптики существен в том случае, когда проявляются волновые свойства заряженных частиц. Хорошей иллюстрацией является нахождение разрешающей способности (предела разрешения), приведенное в начале параграфа.
28.3. ВОЛНОВАЯ ФУНКЦИЯ И ЕЕ ФИЗИЧЕСКИЙ СМЫСЛ
Так как с микрочастицей сопоставляют волновой процесс, который соответствует ее движению, то состояние частиц в квантовой механике описывается волновой функцией, зависящей от координат и времени: ψ(χ, у, z, t).
Если силовое поле, действующее на частицу, является стационарным, т.е. не зависящим от времени, то ψ-функцию можно представить в виде произведения двух сомножителей, один из которых зависит от времени, а другой - от координат:
В дальнейшем будем рассматривать только стационарные состояния; ψ-функция является вероятностной характеристикой состояния частицы. Поясним смысл этого утверждения.
Выделим в пространстве достаточно малый объем d V = dxdjdz, в пределах которого значения ψ-функции можно считать одинаковыми. Вероятность нахождения d W B частицы в этом объеме пропорциональна объему и зависит от квадрата модуля ψ-функции:

Квадрат модуля волновой функции равен плотности вероятности, т.е. отношению вероятности нахождения частицы в объеме к этому объему.
Интегрируя выражение (28.6) по некоторому объему V, находим вероятность нахождения частицы в этом объеме:
28.4. СООТНОШЕНИЯ НЕОПРЕДЕЛЕННОСТЕЙ
Одним из важных положений квантовой механики являются соотношения неопределенностей, предложенные В.Гейзенбергом.
Пусть одновременно измеряют положение и импульс частицы, при этом неточности в определениях абсциссы и проекции импульса на ось абсцисс равны соответственно Δχ и Δр х.

1 Реально осуществить такой опыт невозможно, так как размеры щели должны быть порядка атомов, поэтому описывается некоторый мысленный эксперимент.

шение (28.11) означает, что чем меньше время существования какого-либо состояния системы, тем более неопределенно его значение энергии. Энергетические уровни Е 1 , Е 2 и т.д. имеют некоторую ширину (рис. 28.6), зависящую от времени пребывания системы в состоянии, соответствующем этому уровню.
«Размытость» уровней приводит к неопределенности энергии АЕ излучаемого фотона и его частоты Ау при переходе системы с одного энергетического уровня на другой:
Так как состояние микрочастицы описывают ψ-функцией, то надо указать способ нахождения этой функции с учетом внешних условий. Это возможно в результате решения основного уравнения квантовой механики, предложенного Э. Шредингером (1926). Такое уравнение в квантовой механике постулируется так же, как в классической механике постулируется второй закон Ньютона.
Применительно к стационарным состояниям уравнение Шредин-гера может быть записано так:
Это проявляется в уширении спектральных линий.
28.5. УРАВНЕНИЕ ШРЕДИНГЕРА. ЭЛЕКТРОН В ПОТЕНЦИАЛЬНОЙ ЯМЕ
где m - масса частицы; Е и Е п - ее полная и потенциальная энергии (потенциальная энергия определяется силовым полем, в котором находится частица, и для стационарного случая не зависит от времени).
Если частица перемещается только вдоль некоторой линии, например вдоль оси Х (одномерный случай), то уравнение Шредингера существенно упрощается и принимает вид:
Одним из наиболее простых примеров на использование уравнения Шредингера является решение задачи о движении частицы в одномерной потенциальной яме.
Пусть электрон перемещается вдоль оси Х только в пределах 0 < х < l (рис. 28.7). Это означает, что в указанном интервале ψ-функция отлична от нуля, а вне интервала (х <0, х >l) равна нулю.
Так как на частицу в выделенном интервале силовые поля не действуют, то ее потенциальная энергия может иметь любое постоянное значение (наиболее удобно принять Е п = 0). Вне этого интервала электрона нет, поэтому следует считать его потенциальную энергию бесконечно большой. На рис. 28.7 показана графическая зависимость Е п = Д х). Интервал 0 < х < l, удовлетворяющий сформулированным выше условиям, называют одномерной прямоугольной потенциальной ямой с бесконечно высокими стенками. С учетом Е п = 0 уравнение Шредингера (28.14) для интервала 0 < х < l имеет вид:

Это уравнение аналогично дифференциальному уравнению гармонического колебания (см. 7.1), решение которого:

Прежде всего примечательно, что решение уравнения Шрединге-ра для электрона в потенциальной яме без каких-либо дополнительных постулатов приводит к дискретным, квантованным значениям энергии:

Из (28.21) видно, что при некотором фиксированном значении n дискретность, т.е. различие энергий соседних уровней, тем меньше, чем больше размеры потенциальной ямы. Так, например, рассчитаем два случая при n = 1:
1) l = 5 ? 10 -10 м, что примерно соответствует размерам атома; тогда ΔΕ = 4,5 эВ. Это по порядку величины совпадает со значениями, полученными для атома водорода по теории Бора;
2) l = 10 -1 м, что фактически соответствует такой ширине потенциальной ямы, что электрон можно считать свободным; при этом ΔΕ = 1,1 ? 10 -16 эВ. Здесь дискретность ничтожна и практически можно считать, что энергия электрона изменяется непрерывно.
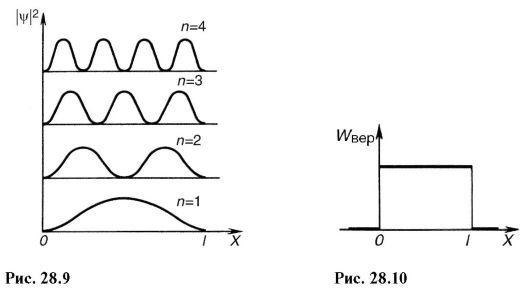
Возведя (28.20) в квадрат, получим плотность вероятности |ψ| 2 нахождения электрона в разных точках потенциальной ямы. На рис. 28.9 показана графическая зависимость |ψ| 2 от χ при разных дискретных состояниях, т.е. разных квантовых числах. Как видно из рисунка, электрон может с разной вероятностью находиться в различных местах потенциальной ямы. Есть такие точки, в которых вероятность нахождения электрона вообще равна нулю. Это существенно отличается от представлений классической физики, согласно которым равновероятно нахождение частицы в разных местах потенциальной ямы (рис. 28.10) и невозможно разделение ямы точками, в которых исключено нахождение частицы.
Уравнение Шредингера можно применить и к более сложным силовым полям, например к электрону в атоме. Это приведет к дополнительным математическим трудностям, но не изменит основных особенностей
атомных систем: дискретности энергетических состояний, вероятностных суждений о нахождении электрона, своеобразной зависимости |ψ| 2 от координат и т.д.
28.6. ПРИМЕНЕНИЕ УРАВНЕНИЯ ШРЕДИНГЕРА К АТОМУ ВОДОРОДА. КВАНТОВЫЕ ЧИСЛА
Описание состояний атомов и молекул с помощью уравнения Шре-дингера является достаточно сложной задачей. Наиболее просто она решается для одного электрона, находящегося в поле ядра. Такие системы соответствуют атому водорода и водородоподобным ионам (однократно ионизированный атом гелия, двукратно ионизированный атом лития и т.п.). Однако и в этом случае решение задачи выходит за рамки нашего курса, поэтому ограничимся лишь качественным изложением вопроса.
Прежде всего в уравнение Шредингера (28.13) следует подставить потенциальную энергию, которая для двух взаимодействующих точечных зарядов - е (электрон) и Ze (ядро), - находящихся на расстоянии r в вакууме, выражается следующим образом:
При центральной симметрии поля, созданного ядром, удобнее решать задачу не в декартовых прямоугольных координатах, а в сферических r, θ и р.
Решение уравнения Шредингера находят в виде произведения трех функций, каждая из которых зависит от одной переменной:
Аналогично тому, как для электрона в прямоугольной потенциальной яме с бесконечно высокими стенками граничные условия привели к конкретным возможным значениям ψ и энергии, так и в потенциальной яме, соответствующей атому водорода, физические условия приводят к возможным значениям f1, f 2 , f 3 и, следовательно, ψ-функции. Здесь также проявляется главная особенность квантово-механических систем - дискретность состояний.
Дискретность математически заключается в том, что любая из функций уравнения (28.23) имеет целый набор (спектр) решений, каждому из которых отвечает определенное квантовое число. В отличие от прямоугольной потенциальной ямы с бесконечно высокими стенками состояние электрона в атоме характеризуется не одним, а несколькими квантовыми числа-ми 1 . Первое из них - главное квантовое число п - 1, 2, 3... Оно определяет уровни энергии электрона по закону:

Это выражение является решением уравнения Шредингера и полностью совпадает с соответствующей формулой теории Бора (см. 28.7).
На рис. 28.11 показаны уровни возможных значений полной энергии атома водорода (Е 1 , Е 2 , Е 3 и т.д.) и график зависимости потенциальной энергии Е П от расстояния r между электроном и ядром [см. (28.22)]. С возрастанием главного квантового числа п увеличивается r [см., например, (28.33)], а полная [см. (28.24)] и потенциальная энергии стремятся к нулю. Кинетическая энергия также стремится к нулю. Заштрихованная область (Е >0) соответствует состоянию свободного электрона.
1 В общем случае квантовыми числами называют целые (0, 1, 2...) или полуцелые (1/2, 3/2, 5/2...) числа, определяющие возможные дискретные значения физических величин, которые характеризуют квантовые системы и элементарные частицы.

1 Наличие спина у частиц не следует из уравнения Шредингера.
с этим расчетом: больше времени она находилась в местах с большей плотностью вероятности, менее длительно - в местах с меньшей плотностью вероятности. В результате экспозиции на фотопленке получились места разной интенсивности, которые иллюстрируют распределение электрона в атоме. Из рисунков видно, сколь условно и даже неверно понятие «орбита» применительно к движению электрона.
Спиновый и орбитальный магнитные моменты взаимодействуют между собой, это изменяет систему энергетических уровней атома по сравнению с той, которая была бы без такого взаимодействия. Говорят, что спин-орбитальное взаимодействие приводит к тонкой структуре энергетических уровней. Если оно существенно, то необходимо учитывать полный момент импульса электрона - орбитальный плюс спиновый. При этом вместо m l и m s используют другие квантовые числа: j и nij.
Квантовое число j - орбитальное плюс спиновое - определяет дискретные значения полного момента импульса L электрона:

Магнитное квантовое число m } характеризует возможные проекции полного момента импульса на некоторое произвольно выбранное направление Z:
При заданном l квантовое число j принимает два значения: ±1/2
(табл. 28.1).
Таблица 28.1

При заданном j квантовое число nij принимает 2j + 1 значений: -j, -j + 1 ... + j.
28.7. ПОНЯТИЕ О ТЕОРИИ БОРА
Еще до создания квантовой механики в 1913 г. датский физик Н. Бор предложил теорию атома водорода и водородоподобных ионов, которая основывалась на ядерной модели атома и двух его постулатах. Постулаты Бора не укладывались в рамки классической физики.
Согласно первому постулату, атом и атомные системы могут длительно пребывать только в некоторых стационарных состояниях. Находясь в таких состояниях, атом не излучает и не поглощает энергии. Стационарным состояниям соответствуют дискретные значения энергии: Е 1 , Е 2 ...
Любое изменение энергии атома или атомной системы связано со скачкообразным переходом из одного стационарного состояния в другое.
По второму постулату, при переходе атома из одного состояния в другое атом испускает или поглощает фотон, энергия которого определяется уравнением (29.1).
Переход от состояния с большей энергией в состояние с меньшей энергией сопровождается излучением фотона. Обратный процесс возможен при поглощении фотона.
Согласно теории Бора, электрон в атоме водорода вращается по круговой орбите вокруг ядра. Из всех возможных орбит стационарные состояния соответствуют только тем, для которых момент импульса равен целому числу h/(2π):
(n = 1, 2, 3...), (28.31)
где m - масса электрона; υ η - его скорость на n-й орбите; rn - ее радиус. На электрон, вращающийся по круговой орбите в атоме, действует куло-новская сила притяжения со стороны положительно заряженного ядра, которая, по второму закону Ньютона, равна произведению массы электрона на центростремительное ускорение (запись дана для вакуума):

Несмотря на большой успех теории Бора, скоро стали заметны и ее недостатки. Так, в рамках этой теории не удалось объяснить различие интенсивностей спектральных линий, т.е. ответить на вопрос, почему одни энергетические переходы более вероятны, чем другие. Теория Бора не раскрыла спектральных закономерностей более сложной атомной системы - атома гелия (два электрона, вращающиеся вокруг ядра).
Недостатком теории Бора была ее непоследовательность. Эта теория не была ни классической, ни квантовой, она объединяла в себе положения принципиально отличных теорий: классической и квантовой физики. Так, например, в теории Бора считается, что электрон вращается в атоме по определенной орбите (классические представления), но при этом он не излучает электромагнитной волны (квантовые представления).
В первой четверти нашего века стало ясно, что теория Бора должна быть заменена другой теорией атома. Появилась квантовая механика.
28.8. ЭЛЕКТРОННЫЕ ОБОЛОЧКИ СЛОЖНЫХ АТОМОВ
Квантовые числа, описывающие состояние электрона в атоме водорода, используют для приближенной характеристики состояния отдельных электронов сложных атомов. Однако при этом следует учитывать по крайней мере два существенных отличия сложных атомов от атома водорода:
1) в сложных атомах энергия электронов из-за их взаимодействия зависит не только от n, но и от /;
2) отличие обусловлено принципом Паули, согласно которому в атоме не может быть двух (и более) электронов с четырьмя одинаковыми квантовыми числами.
При образовании электронной конфигурации, соответствующей нормальному состоянию, каждый электрон атома стремится иметь наименьшую энергию. Если бы не принцип Паули, то все электроны расположились бы на самом нижнем энергетическом уровне. Фактически же, за некоторыми исключениями, электроны занимают ту последовательность состояний, которая указана для атома водорода в табл. 29.
Электроны с одинаковым главным квантовым числом образуют слой. Слои называются К, L, М, N и т.д. в соответствии с n = 1, 2, 3, 4... Электроны, имеющие одинаковые пары значений n и / , входят в состав оболочки, которая кратко обозначается так же, как соответствующие состояния для электрона атома водорода: 1s, 2s, 2^ и т.д. Так, например, называют 2s-оболочка, 2s-электроны и т.п.
Число электронов в оболочке обозначают справа вверху около символической записи оболочки, например 2р 4 .
Распределение электронов по оболочкам в атоме (электронные конфигурации) обычно указывают следующим образом: для азота 1s 2 , 2s 2 , 2р 3 , для кальция 1s 2 , 2s 2 , 2р 6 , 3s 2 , 3р 6 , 4s 2 и т.д.
Так как энергия электронов сложных атомов зависит не только от n, но и от l, то построение таблицы Менделеева не всегда происходит постепенным заполнением слоев по мере усложнения атома. У калия (Z = 19), например, вместо заполнения слоя М (возможно, было 1s 2 , 2s 2 , 2^ 6 , 3s 2 , 3р 6 , 3а 1) начинается заполнение слоя N и создается следующая электронная конфигурация: 1 s 2 , 2s 2 , 2р 6, 3s 2, 3р 6, 4s 1.
Аналогичные отклонения от регулярного заполнения слоев имеются и у других элементов.
Всегда выполняется общее правило: электроны невозбужденного атома занимают состояние с наименьшей энергией и в соответствии с принципом Паули. На рис. 28.13 схематически без соблюдения масштаба показаны энергетические состояния сложного атома и соответствующее им число электронов.
В заключение отметим, что состояние многоэлектронного атома в целом определяется следующими квантовыми числами: L - полного орбитального момента атома, которое принимает значения 0, 1, 2, 3 и т.д. 1 ; J - полного момента атома, которое может принимать значения с интервалом в единицу от |L - S | до |L + S |; S - результирующего спинового момента атома; магнитного m J , который определяет дискретные значения проекции полного момента атома на некоторую ось Z:

При заданном Jm J принимает 2J + 1 значений:
-J, -J + 1 ... +J.
1 Не следует смешивать это обозначение с названием электронного слоя L и с полным моментом импульса электрона.
28.9. ЭНЕРГЕТИЧЕСКИЕ УРОВНИ МОЛЕКУЛ
Так как молекулы состоят из атомов, то внутримолекулярное движение сложнее внутриатомного. В молекуле кроме движения электронов относительно ядер происходит колебательное движение атомов около их положения равновесия (колебание ядер вместе с окружающими их электронами) и вращательное движение молекулы как целого.
Электронному, колебательному и вращательному движениям молекулы соответствуют три типа уровней энергии: Е эл, Е кол и Е вр. Согласно квантовой механике, энергия всех видов движения в молекуле принимает только дискретные значения (квантуется). Представим приближенно полную энергию Е молекулы суммой квантованных значений энергий разных видов:
Е = Е эл + Е кол + Е вр. (28.37)
На рис. 28.14 схематически изображена система уровней молекулы: далеко отстоящие электронные уровни энергии а" и а" ", для которых Е кол = Е вр = 0; более близко расположенные колебательные уровни v" , v" ", для них Е вр = 0; наиболее тесно расположенные вращательные уровни J" и J"" с различными значениями Е вр.
Расстояние между электронными уровнями энергии порядка нескольких электрон-вольт, между соседними колебательными уровнями 10 -2 -10 -1 эВ, между соседними вращательными уровнями 10 -5 -10 -3 эВ.

Недостатки теории Бора указывали на необходимость пересмотра основ квантовой теории и представлений о природе микрочастиц (электронов, протонов и т.п.). Возник вопрос о том, насколько исчерпывающим является представление электрона в виде малой механической частицы, характеризующейся определенными координатами и определенной скоростью.
Мы уже знаем, что в оптических явлениях наблюдается своеобразный дуализм. Наряду с явлениями дифракции, интерференции (волновыми явлениями) наблюдаются и явления, характеризующие корпускулярную природу света (фотоэффект, эффект Комптона).
В 1924 г. Луи де Бройль выдвинул гипотезу, что дуализм не является особенностью только оптических явлений , а имеет универсальный характер. Частицы вещества также обладают волновыми свойствами .
«В оптике, – писал Луи де Бройль, – в течение столетия слишком пренебрегали корпускулярным способом рассмотрения по сравнению с волновым; не делалась ли в теории вещества обратная ошибка?» Допуская, что частицы вещества наряду с корпускулярными свойствами имеют также и волновые, де Бройль перенес на случай частиц вещества те же правила перехода от одной картины к другой, какие справедливы в случае света.
Если фотон обладает энергией и импульсом , то и частица (например электрон), движущаяся с некоторой скоростью, обладает волновыми свойствами, т.е. движение частицы можно рассматривать как движение волны.
Согласно квантовой механике, свободное движение частицы с массой m и импульсом (где υ – скорость частицы) можно представить как плоскую монохроматическую волну (волну де Бройля ) с длиной волны
| (3.1.1) |
распространяющуюся в том же направлении (например в направлении оси х ), в котором движется частица (рис. 3.1).

Зависимость волновой функции от координаты х даётся формулой
| , | (3.1.2) |
где – волновое число ,а волновой вектор направлен в сторону распространения волны или вдоль движения частицы:
| . | (3.1.3) |
Таким образом, волновой вектор монохроматической волны , связанной со свободно движущейся микрочастицей, пропорционален её импульсу или обратно пропорционален длине волны .
Поскольку кинетическая энергия сравнительно медленно движущейся частицы , то длину волны можно выразить и через энергию:
| . | (3.1.4) |
При взаимодействии частицы с некоторым объектом – с кристаллом, молекулой и т.п. – её энергия меняется: к ней добавляется потенциальная энергия этого взаимодействия, что приводит к изменению движения частицы. Соответственно, меняется характер распространения связанной с частицей волны, причём это происходит согласно принципам, общим для всех волновых явлений. Поэтому основные геометрические закономерности дифракции частиц ничем не отличаются от закономерностей дифракции любых волн. Общим условием дифракции волн любой природы является соизмеримость длины падающей волны λ с расстоянием d между рассеивающими центрами : .
Гипотеза Луи де Бройля была революционной, даже для того революционного в науке времени. Однако, она вскоре была подтверждена многими экспериментами.
К началу XX века в оптике были известны как явления, подтверждающие наличие волновых свойств у света (интерференция, поляризация, дифракция и др.), так и явления, нашедшие объяснение с позиций корпускулярной теории (фотоэффект, эффект Комптона и др.). В начале XX века для частиц вещества был обнаружен ряд эффектов, внешне сходных с оптическими явлениями, характерными для волн. Так, в 1921 году Рамзауэр при исследовании рассеяния электронов на атомах аргона обнаружил, что при уменьшении энергии электрона от нескольких десятков электрон-вольт эффективное сечение упругого рассеяния электронов на аргоне растет (рисунок 4.1).
Но при энергии электрона ~16 эВ эффективное сечение достигает максимума и при дальнейшем уменьшении энергии электрона уменьшается. При энергии электрона ~ 1 эВ становится близким к нулю, а затем начинает снова увеличиваться.
Таким образом, вблизи ~ 1 эВ электроны как бы не испытывают с атомами аргона столкновений и пролетают через газ без рассеяния. Такое же поведение характерно и для сечения рассеяния электронов на других атомах инертных газов, а также на молекулах (последнее обнаружено Таунсендом). Этот эффект аналогичен образованию пятна Пуассона при дифракции света на малом экране.
Другой интересный эффект - селективное отражение электронов от поверхности металлов; оно изучалось в 1927 году американскими физиками Дэвиссоном и Джермером, а также независимо от них английским физиком Дж. П. Томсоном.
Параллельный пучок моноэнергетических электронов из электронно-лучевой трубки (рисунок 4.2) направляли на никелевую пластинку. Отраженные электроны улавливались коллектором, соединенным с гальванометром. Коллектор устанавливается под любым углом относительно падающего пучка (но в одной плоскости с ним).
В результате опытов Дэвиссона-Джермера показано, что угловое распределение рассеянных электронов имеет такой же характер, как и распределение рентгеновских лучей, рассеянных кристаллом (рисунок 4.3). При изучении дифракции рентгеновских лучей на кристаллах было установлено, что распределение дифракционных максимумов описывается формулой
где - постоянная кристаллической решетки, - порядок дифракции, - длина волны рентгеновского излучения.
В случае рассеяния нейтронов на тяжелом ядре также возникало типично дифракционное распределение рассеянных нейтронов, аналогичное наблюдаемому в оптике при дифракции света на поглощающем диске или шарике.
Французский ученый Луи де Бройль в 1924 году высказал идею о том, что частицы вещества обладают и корпускулярными, и волновыми свойствами. При этом он предположил, что частице, свободно движущейся с постоянной скоростью, соответствует плоская монохроматическая волна
где и - ее частота и волновой вектор.
Волна (4.2) распространяется в направлении движения частицы (). Такие волны получили название фазовых волн , волн вещества или волн де Бройля .
Идея де Бройля заключалась в том, чтобы расширить аналогию между оптикой и механикой, а волновую оптику сопоставить с волновой механикой, пытаясь применить последнюю к внутриатомным явлениям. Попытка приписать электрону, и вообще всем частицам, подобно фотонам, двойственную природу, наделить их волновыми и корпускулярными свойствами, связанными между собой квантом действия, - такая задача представлялась крайне необходимой и плодотворной. ”…Необходимо создать новую механику волнового характера, которая будет относиться к старой механике как волновая оптика к геометрической оптике”, - писал де Бройль в книге «Революция в физике».
Частица массы, движущаяся со скоростью, имеет энергию
и импульс
а состояние движения частицы характеризуется четырехмерным вектором энергии-импульса ().
С другой стороны, в волновой картине мы используем понятие частоты и волнового числа (или длины волны), а соответствующим плоской волне 4-вектором является ().
Так как оба приведенных описания являются различными аспектами одного и того же физического объекта, то между ними должна существовать однозначная связь; релятивистски инвариантным соотношением между 4-векторами является
Выражения (4.6) называются формулами де Бройля . Длина волны де Бройля определяется, таким образом, формулой
(здесь). Именно эта длина волны должна фигурировать в формулах при волновом описании эффекта Рамзауэра - Таунсенда и опытов Дэвиссона - Джермера.
Для электронов, ускоренных электрическим полем с разностью потенциалов В, длина волны де Бройля нм; при кВ =0,0122 нм. Для молекулы водорода с энергией Дж (при = 300 К) =0,1 нм, что по порядку величины совпадает с длиной волны рентгеновского излучения.
С учетом (4.6) формулу (4.2) можно записать в виде плоской волны
соответствующей частице, имеющей импульс и энергию.
Волны де Бройля характеризуются фазовой и групповой скоростями. Фазовая скорость определяется из условия постоянства фазы волны (4.8) и для релятивистской частицы равна
то есть она всегда больше скорости света. Групповая скорость волн де Бройля равна скорости движения частицы:
Из (4.9) и (4.10) следует связь между фазовой и групповой скоростями волн де Бройля:
Каков же физический смысл волн де Бройля и какова их связь с частицами вещества?
В рамках волнового описания движения частицы значительную гносеологическую сложность представил вопрос о ее пространственной локализации. Волны де Бройля (4.2), (4.8) заполняют все пространство и существуют неограниченное время. Свойства этих волн всегда и везде одинаковы: постоянны их амплитуда и частота, неизменны расстояния между волновыми поверхностями и др. С другой стороны, микрочастицы сохраняют свои корпускулярные свойства, то есть обладают определенной массой, локализованной в определенной области пространства. Для того, чтобы выйти из создавшегося положения, частицы стали представлять не монохроматическими волнами де Бройля, а наборами волн с близкими частотами (волновыми числами) - волновыми пакетами :

при этом амплитуды отличны от нуля лишь для волн с волновыми векторами, заключенными в интервале (). Поскольку групповая скорость волнового пакета равна скорости движения частицы, то было предложено представить частицу в виде волнового пакета. Но эта идея несостоятельна по следующим причинам. Частица является стабильным образованием и в процессе своего движения как таковая не изменяется. Такими же свойствами должен обладать и волновой пакет, претендующий представлять частицу. Поэтому нужно потребовать, чтобы с течением времени волновой пакет сохранял свою пространственную форму или - по меньшей мере - свою ширину. Однако так как фазовая скорость зависит от импульса частицы, то (даже в вакууме!) должна существовать дисперсия волн де Бройля. В результате фазовые соотношения между волнами пакета нарушаются, и пакет расплывается. Следовательно, частица, представляемая таким пакетом, должна быть нестабильной. Этот вывод противоречит опыту.
Далее было выдвинуто противоположное предположение: частицы первичны, а волны представляют их образования, то есть возникают, подобно звуку в среде, состоящей из частиц. Но такая среда должна быть достаточно плотной, ведь о волнах в среде частиц имеет смысл говорить лишь тогда, когда среднее расстояние между частицами очень мало по сравнению с длиной волны. А в экспериментах, в которых обнаруживаются волновые свойства микрочастиц, это не выполняется. Но даже если преодолеть это затруднение, то все равно указанная точка зрения должна быть отвергнута. В самом деле, она означает, что волновые свойства присущи системам многих частиц, а не отдельным частицам. Между тем волновые свойства частиц не исчезают и при малых интенсивностях падающих пучков. В опытах Бибермана, Сушкина и Фабриканта, проведенных в 1949 году, применялись столь слабые пучки электронов, что средний промежуток времени между двумя последовательными прохождениями электрона через дифракционную систему (кристалл) было в 30000 (!) раз больше времени, затрачиваемого одним электроном на прохождение всего прибора. При таких условиях взаимодействие между электронами, конечно, не играло никакой роли. Тем не менее при достаточно длительной экспозиции на фотопленке, помещенной за кристаллом, возникала дифракционная картина, ничем не отличающаяся от картины, получаемой при короткой экспозиции с пучками электронов, интенсивность которых была в 10 7 раз больше. Важно только, чтобы в обоих случаях общее число электронов, попадающих на фотопластинку, было одинаковым. Это показывает, что и отдельные частицы обладают волновыми свойствами. Эксперимент показывает, что одна частица дифракционной картины не дает, каждый отдельный электрон вызывает почернение фотопластинки на небольшом участке. Всю дифракционную картину можно получить только благодаря попаданию на пластинку большого числа частиц.
Электрон в рассмотренном опыте полностью сохраняет свою целостность (заряд, массу и другие характеристики). В этом проявляются его корпускулярные свойства. В то же время налицо проявление и волновых свойств. Электрон никогда не попадает на тот участок фотопластинки, где должен быть минимум дифракционной картины. Он может оказаться только вблизи положения дифракционных максимумов. При этом нельзя заранее указать, в каком конкретном направлении полетит данная конкретная частица.
Представление о том, что в поведении микрообъектов проявляются как корпускулярные, так и волновые свойства, закреплено в термине «корпускулярно-волновой дуализм» и лежит в основе квантовой теории, где он и получил естественное истолкование.
Борн предложил следующую общепринятую теперь интерпретацию результатов описанных опытов: вероятность попадания электрона в некоторую точку на фотопластинке пропорциональна интенсивности соответствующей волны де Бройля, то есть квадрату амплитуды волнового поля в данном месте экрана. Таким образом, предложено вероятностно-статистическое толкование природы волн, связанных с микрочастицами: закономерность распределения микрочастиц в пространстве можно установить только для большого числа частиц; для одной частицы можно определить только вероятность попадания в определенную область.
После знакомства с корпускулярно-волновым дуализмом частиц ясно, что для описания механического состояния микрочастиц непригодны те методы, которые используются в классической физике. В квантовой механике для описания состояния нужно применять новые специфические средства. Важнейшим из них является понятие о волновой функции, или функции состояния (-функции ).
Функция состояния есть математический образ того волнового поля, которое следует связывать с каждой частицей. Так, функцией состояния свободной частицы является плоская монохроматическая волна де Бройля (4.2) или (4.8). Для частицы, подверженной внешнему воздействию (например, для электрона в поле ядра), это волновое поле может иметь весьма сложный вид, и оно изменяется с течением времени. Волновая функция зависит от параметров микрочастицы и от тех физических условий, в которых частица находится.
Далее мы увидим, что через волновую функцию достигается наиболее полное описание механического состояния микрообъекта, какое только возможно в микромире. Зная волновую функцию, можно предсказать, какие значения всех измеряемых величин могут наблюдаться на опыте и с какой вероятностью. Функция состояния несет всю информацию о движении и квантовых свойствах частиц, поэтому говорят о задании с ее помощью квантового состояния.
Согласно статистической интерпретации волн де Бройля, вероятность локализации частицы определяется интенсивностью волны де Бройля, так что вероятность обнаружения частицы в малом объеме в окрестности точки в момент времени равна
С учетом комплексности функции имеем:
Для плоской волны де Бройля (4.2)
то есть равновероятно обнаружить свободную частицу в любом месте пространства.
Величину
называют плотностью вероятности. Вероятность найти частицу в момент времени в конечном объеме, согласно теореме сложения вероятностей, равна
Если в (4.16) произвести интегрирование в бесконечных пределах, то будет получена полная вероятность обнаружения частицы в момент времени где-нибудь в пространстве. Это - вероятность достоверного события, поэтому
Условие (4.17) называется условием нормировки , а -функцию, удовлетворяющую ему, - нормированной .
Подчеркнем еще раз, что для частицы, движущейся в силовом поле, в качестве выступает функция более сложного вида, чем плоская волна де Бройля (4.2).
Так как -функция комплексна, то ее можно представить в виде
где - модуль -функции, а - фазовый множитель, в котором - любое вещественное число. Из совместного рассмотрения этого выражения и (4.13) ясно, что нормированная волновая функция определена неоднозначно, а лишь с точностью до постоянного множителя. Отмеченная неоднозначность принципиальная и не может быть устранена; однако она несущественна, так как не отражается ни на каких физических результатах. Действительно, умножение функции на экспоненту изменяет фазу комплексной функции, но не ее модуль, определяющий вероятность получения в эксперименте того или иного значения физической величины.
Волновую функцию частицы, движущейся в потенциальном поле, можно представить волновым пакетом. Если при движении частицы вдоль оси длина волнового пакета равна, то волновые числа, необходимые для его образования, не могут занимать сколь угодно узкий интервал. Минимальная ширина интервала должна удовлетворять соотношению или, после умножения на,
Аналогичные соотношения выполняются и для волновых пакетов, распространяющихся вдоль осей и:
Соотношения (4.18), (4.19) называют соотношениями неопределенностей Гейзенберга (или принципом неопределенности ). Согласно этому фундаментальному положению квантовой теории, любая физическая система не может находиться в состояниях, в которых координаты ее центра инерции и импульс одновременно принимают вполне определенные, точные значения.
Соотношения, аналогичные записанным, должны выполняться для любой пары так называемых канонически сопряженных величин. Содержащаяся в соотношениях неопределенностей постоянная Планка устанавливает предел в точности одновременного измерения таких величин. При этом неопределенность в измерениях связана не с несовершенством экспериментальной техники, а с объективными (волновыми) свойствами частиц материи.
Другим важным моментом в рассмотрении состояний микрочастиц является воздействие прибора на микрообъект. Любой процесс измерения приводит к изменению физических параметров состояния микросистемы; нижний предел этого изменения устанавливается также соотношением неопределенностей.
Ввиду малости по сравнению с макроскопическими величинами той же размерности действия соотношения неопределенностей существенны в основном для явлений атомных и меньших масштабов и не проявляются в опытах с макроскопическими телами.
Соотношения неопределенностей, впервые полученные в 1927 году немецким физиком В. Гейзенбергом, явились важным этапом в выяснении закономерностей внутриатомных явлений и построении квантовой механики.
Как следует из статистической интерпретации смысла волновой функции, частица может быть с некоторой вероятностью обнаружена в любой точке пространства, в которой волновая функция отлична от нуля. Поэтому результаты экспериментов по измерению, например, координаты носят вероятностный характер. Это означает, что при проведении серии одинаковых экспериментов над одинаковыми системами (то есть при воспроизведении одинаковых физических условий) получаются каждый раз разные результаты. Однако некоторые значения будут более вероятными, чем другие, и будут появляться чаще. Чаще всего будут получаться те значения координаты, которые близки к значению, определяющему положение максимума волновой функции. Если максимум выражен четко (волновая функция представляет собой узкий волновой пакет), то частица в основном находится вблизи этого максимума. Тем не менее некоторый разброс в значениях координаты (неопределенность порядка полуширины максимума) неизбежен. То же относится и к измерению импульса.
В атомных системах величина по порядку величины равна площади орбиты, по которой, в соответствии с теорией Бора-Зоммерфельда, движется частица в фазовой плоскости. В этом можно убедиться, выражая площадь орбиты через фазовый интеграл. При этом получится, что квантовое число (смотри лекцию 3) удовлетворяет условию
В отличие от теории Бора, где имеет место равенство (здесь - скорость электрона на первой боровской орбите в атоме водорода, - скорость света в вакууме,), в рассматриваемом случае в стационарных состояниях средний импульс определяется размерами системы в координатном пространстве, а отношение составляет лишь по порядку величины . Таким образом, применяя координаты и импульс для описания микроскопических систем, необходимо в интерпретацию этих понятий ввести квантовые поправки. Такой поправкой и являются соотношения неопределенностей.
Несколько иной смысл имеет соотношение неопределенностей для энергии и времени:
Если система находится в стационарном состоянии, то из соотношения неопределенностей следует, что энергию системы даже в этом состоянии можно измерить лишь с точностью, не превышающей, где - длительность процесса измерения. Соотношение (4.20) справедливо также, если под понимать неопределенность значения энергии нестационарного состояния замкнутой системы, а под - характерное время, в течение которого существенно меняются средние значения физических величин в этой системе.
Соотношение неопределенностей (4.20) приводит к важным выводам относительно возбужденных состояний атомов, молекул, ядер. Такие состояния нестабильны, и из соотношения неопределенностей вытекает, что энергии возбужденных уровней не могут быть строго определенными, то есть энергетические уровни обладают некоторой естественной шириной , где - время жизни возбужденного состояния. Другим примером служит альфа-распад радиоактивного ядра. Энергетический разброс испускаемых -частиц связан с временем жизни такого ядра соотношением.
Для нормального состояния атома, а энергия имеет вполне определенное значение, то есть . Для нестабильной частицы с, и об определенном значении ее энергии говорить не приходится. Если время жизни атома в возбужденном состоянии принять равным с, то ширина энергетического уровня ~10 -26 Дж и ширина спектральной линии, возникающей при переходе атома в нормальное состояние, ~10 8 Гц.
Из соотношений неопределенностей следует вывод о том, что в квантовой механике теряет смысл деление полной энергии на кинетическую и потенциальную. Действительно, одна из них зависит от импульсов, а другая - от координат. Эти же переменные не могут одновременно иметь определенные значения. Энергия должна определяться и измеряться лишь как полная энергия, без деления на кинетическую и потенциальную.
ННАЯ ОБОЛОЧКА АТОМА ХИМИЧЕСКОГО ЭЛЕМЕНТА
§ 1. ИСХОДНЫЕ ПРЕДСТАВЛЕНИЯ КВАНТОВОЙ МЕХАНИКИ
Теория строения атома основана на законах, описывающих движение микрочастиц (электронов, атомов, молекул) и их систем (например, кристаллов). Массы и размеры микрочастиц чрезвычайно малы по сравнению с массами и размерами макроскопических тел. Поэтому свойства и закономерности движения отдельной микрочастицы качественно отличаются от свойств и закономерностей движения макроскопического тела, изучаемых классической физикой. Движение и взаимодействия микрочастиц описывает квантовая (или волновая) механики. Она основывается на представлении о квантовании энергии, волновом характере движения микрочастиц и вероятностном (статистическом) методе описания микрообъектов.
Квантовый характер излучения а поглощения энергии. Примерно в начале XX в. исследования ряда явлений (излучений раскаленных тел, фотоэффект, атомные спектры) привели к выводу, что энергия распространяется и передается, поглощается и испускается не непре-16 рывно, а дискретно, отдельными порциями - квантами. Энергия системы микрочастиц также может принимать только определенные значения, которые являются кратными числами квантов.
Предположение о квантовой энергии впервые было высказано М. Планком (1900) и позже обосновано А. Эйнштейном (1905). Энергия кванта? зависит от частоты излучения v:
где h - постоянная Планка }